Gentherapie (genetische Therapie) bei Mukoviszidose: Was ist in Zukunft zu erwarten?

Mit genetischen Therapien verbinden die meisten Menschen die Heilung einer genetischen Erkrankung – also eine dauerhafte Korrektur von Gendefekten (Mutationen) auf Ebene des Erbguts, der DNA – und zwar in allen Zellen – und für immer! Eine solche Gentherapie wird seit Jahrzehnten erforscht, führte bei Mukoviszidose bislang aber nicht zum Erfolg. Auf dieser Seite haben wir den aktuellen Forschungsstand zum Thema Gentherapie bei Mukoviszidose für Sie zusammengefasst.
Warum gibt es noch keine Gentherapie bei Mukoviszidose?
Das hat viele Gründe: Der menschliche Organismus besteht aus Billionen von Körperzellen, die sich in regelmäßigen Abständen erneuern. Eine genetische Therapie müsste eine Vielzahl von Zellen ansteuern oder mindestens die Vorläuferzellen, aus denen sich die spezialisierten Zelltypen regelmäßig erneuern. Dabei muss das Medikament nicht nur die richtigen Zellen erreichen, sondern auch noch bis in den Zellkern gebracht werden und die dort liegende DNA im Gen dauerhaft durch ein funktionierendes Gen ersetzen. Und das alles muss fehlerfrei und zuverlässig erfolgen – bevor eine Gentherapie in eine klinische Anwendung gehen soll!
Genetische Therapien: Reparatur vor Ort, Ersatzgen oder mRNA als Genkopie?
Ein Ersatz-Gen dauerhaft in den Zellkern einzubringen oder ein defektes Gen im Zellkern zu korrigieren, ist das, was streng genommen unter Gentherapie zu verstehen ist. Inzwischen gibt es aber verschiedene Ansätze, die auch auf Ebene der Gene der ausgereiften Zellen oder deren Kopie, der mRNA ansetzen und vielleicht sogar früher zum Erfolg führen – wenn sie auch keine Heilung für immer versprechen wie eine erfolgreiche Gentherapie im klassischen Sinne. Aus diesem Grund setzt sich auch in der Forschung immer mehr der Ausdruck „Genetische Therapie oder Genbasierte Therapie“ durch, unter dem alle Ansätze zu verstehen sind, die in der Zelle auf dem Weg vom Gen bis zur Proteinherstellung ansetzen. (Wirkstoffe, die hingegen am CFTR-Protein ansetzen, werden als CFTR- Modulatoren bezeichnet und sind in der klinischen Anwendung angekommen. CFTR-Modulatoren ermöglichen eine „kausale“ Therapie, d. h. die Behandlung der Ursache der Erkrankung und nicht „nur“ die Bekämpfung von Symptomen.)
Ihre Ansprechpartnerin

Dr. Sylvia Hafkemeyer
Forschungsförderung / Registerstudien
Tel.: +49 (0)228 98780-42
E-Mail: SHafkemeyer(at)muko.info
Übersicht über genetische Therapien in der klinischen Entwicklung
mRNA-Therapien
| Wirkstoff | Entwicklungsphase | Mutationen | Vektor | Status | Weitere Informationen |
|---|---|---|---|---|---|
| VX-522 | Phase 1/2 | alle | Lipidnanopartikel | Studie in USA, Australien, Europa bis 2027 | |
| ARCT-032 (LUNAR-CF) | Phase 2 | alle | Lipidnanopartikel | Studie (LunairCF) in USA und Europa bis 2026 | |
| RCT2100 | Phase 1/2 | alle | Lipidnanopartikel | Studie in USA, Europa bis 2026 |
Antisense-Oligonukleotide (ASO)
| Wirkstoff | Entwicklungsphase | Mutationen | Vektor | Status | Weitere Informationen |
|---|---|---|---|---|---|
| SPL84 | Phase 2 | 3849+10 kb C->T | ohne Vektor | Studie in USA und Europa | Informationen in Studiendatenbank (engl.) |
Klassische Gentherapien (DNA)
| Wirkstoff | Entwicklungsphase | Mutationen | Vektor | Status | Weitere Informationen |
|---|---|---|---|---|---|
| 4D-710 | Phase 1/2 | alle | AAV (viraler Vektor) | Studie in USA bis 2030 | |
| KB407 | Phase 1 | alle | HSV (viraler Vektor) | Studie in USA bis 2025 | |
| SP-101 | Phase 1/2 | alle | AAV (viraler Vektor) | Studie in USA bis 2026 | |
| BI 3720931 | Phase 1/2 | alle | Lentivirus | Studie (Lenticlair) in Frankreich, Spanien, Niederlanden, Italien, UK bis 2028 |
Ansätze auf Ebene der Erbsubstanz, der DNA
Gelänge es, Mutationen im Gen durch eine fehlerfreie „Reparatur vor Ort“ oder durch den Einbau eines Ersatzgens stabil und sicher im Erbgut vorzunehmen, so könnte man von einer klassischen Gentherapie sprechen, die einer Heilung der Erkrankung gleichkommt. Veränderungen im Erbgut würden dann auch bei Teilung an die Tochterzellen weitergegeben – und auch diese Tochterzellen wären geheilt. Doch im menschlichen Organismus sind die meisten Zellen und auch die des Lungenepithels spezialisierte, ausgereifte Zellen, die selber keine Tochterzellen mehr ausbilden. Eine Korrektur deren Erbguts, d. h. der Gene dieser Zellen, ist demnach nur vorübergehend (transient). Nachwachsende Zellen des Lungenepithels müssten erneut therapiert werden. Es gibt aber auch im ausgewachsenen Organismus selten vorkommende Vorläuferzellen, die teilungsfähig bleiben und aus spezialisierten Zellen für Erneuerungsprozesse (Regeneration von Gewebe) nachwachsen. Für eine dauerhafte Gentherapie bei Mukoviszidose müsste man genau solche Vorläuferzellen finden und erfolgreich behandeln.
Übrigens: Weltweit nicht erlaubt ist die Manipulation des Erbmaterials von Keimzellen (Keimbahntherapie), d.h. die Gentherapie an Ei- oder Spermienzellen oder auch befruchteter Eizellen und Embryos, da solche Gentherapien alle Nachkommen betreffen würden und ethische Bedenken und Sicherheitsaspekte gegen Genmanipulationen an allen Nachfolgegenerationen sprechen.
Gentherapie kann nur wirken, wenn die richtigen Zellen erreicht werden
Dauerhafte genetische Veränderungen im Sinne einer Heilung könnten daher nur an Stammzellen vorgenommen werden, die als Vorläuferzellen dienen und durch Zellteilung andere Körperzellen hervorbringen.
Zellatlas der Lunge: Die Rolle der verschiedenen Zelltypen wird entschlüsselt
Neueste Methoden machen es möglich, dass Forscher Lungengewebe bis auf die Ebene der einzelnen Zellen hinsichtlich ihrer Genaktivität analysieren können, um zu verstehen, welche Gene in den verschiedenen Zelltypen aktiv sind und auch, wie deren Häufigkeit und Ähnlichkeit der Zelltypen zueinander ist. Diese Forschung ist erst in den vergangenen Jahren möglich geworden und CF-relevante Ergebnisse wurden erstmals 2021 auf dem europäischen und dem amerikanischen CF-Kongress veröffentlicht. Die Forscher sprechen von einem Zellatlas, der ihnen hilft, zu verstehen, welche Zelltypen wo und wie häufig vorkommen – und wo das CFTR-Gen gebraucht wird – eine wichtige Voraussetzung für genetische Therapien.
Langfristig wirkende genetische Therapien müssen Basalzellen erreichen
Die Forscher gehen aktuell davon aus, dass für eine langfristigere Heilung in der Lunge die Basalzellen (teilungsfähige Vorläuferzellen) erreicht werden müssen. Sinnvolle Zielzellen für eine vorübergehende Wirkung sind vor allem die vielen sekretorischen Zellen (das sind bereits fertige, ausgereifte Zellen im Lungenepithel), denn diese stellen absolut gesehen das meiste CFTR-Protein in der Lunge her – diese Zellen sterben aber irgendwann ab und damit geht die Wirkung wieder verloren. Ob die erst vor wenigen Jahren entdeckten Ionozyten (sind extrem selten im Lungengewebe zu finden, stellen den CFTR Kanal aber auch in extrem hoher Menge her) eine sinnvolle Zielzelle für eine genetische Therapie darstellen, wird derzeit noch diskutiert.
Vektoren müssen die ausgewählten Zellen erreichen – und nur die!
Für die praktische Anwendung einer genetischen Therapie werden damit gleich ganz andere Anforderungen gestellt: Die sekretorischen Zellen könnten über inhalative Darreichungsformen erreicht werden, die tiefer im Lungengewebe liegenden Basalzellen wären eher über die Blutbahn erreichbar. Eine solche Ansteuerung von Zielzellen ist über verschiedene Transportvehikel, die Vektoren, möglich. Die Entwicklung von Vektoren ist dabei schon wieder ein eigenes Forschungsgebiet, dem sich aktuell viele akademische Forschungsgruppen und verschiedene Firmen widmen (s. u.).
Genetische Therapien an Körperzellen machbar und für andere Erkrankungen zugelassen
Alle Eingriffe auf Ebene der Gene müssen mit sehr großer Sicherheit fehlerfrei ablaufen, denn es muss unbedingt verhindert werden, dass andere Gene verändert oder krebsverursachende Gene in der Zelle aktiviert werden. Dass langfristig wirkende genetische Therapien aber machbar sind, zeigen Zulassungen bei anderen Erkrankungen.
CRISPR/Cas ist ein Werkzeug mit hoher Präzision – für den Einsatz im Menschen muss es fehlerfrei arbeiten!
Die 2015 entdeckten bakteriellen Enzyme CRISPR/Cas sind darauf spezialisiert, Erbgut an vorgesehenen DNA-Bereichen sehr präzise zu schneiden. Molekularbiologen haben das System inzwischen optimiert, indem die Schnittstelle auf der DNA je nach Belieben (und je nach Mutation und Erkrankung) von den Forschern bestimmt werden kann und auch die Art der Reparatur genau gesteuert werden kann. Man spricht hier von Gene-Editing, da die Gene im Erbgut wie Wörter in einem Text korrigiert werden können. Experten entwickelten die Methoden sogar noch weiter und können durch Base-Editing oder Prime-Editing die Genreparatur durch das CRISPR/Cas System noch spezifischer vornehmen lassen.
Die molekularen Werkzeuge für eine Reparatur direkt am Genom im Zellkern werden immer besser und eine solche Therapie an Körperzellen daher immer wahrscheinlicher. Eine Zulassung für eine „Reparatur vor Ort, d. h. im Menschen“ durch die molekulare Schere CRISPR/Cas ist bislang jedoch noch nicht erfolgt, allerdings wurde kürzlich erstmals ein Geneditierungsarzneimittel zugelassen, bei dem „Gene-Editing“ durch CRISPR/Cas an entnommenen Blutzellen angewendet wurde (ex-vivo) und diese korrigierten Zellen dann verabreicht wurden.
Weitere Informationen zum Gene-Editing in einer früheren Newsmeldung
Für Mukoviszidose bräuchte man allerdings aufgrund der vielen verschiedenen Mutationen vermutlich verschiedene Gene-Editing-Medikamente. Verschiedene Ansätze werden derzeit in Europäischen Arbeitsgruppen erforscht, zum Beispiel bei den Mutationen L227R, N1303K, G542X, W1282X, R1158X, R1162X, 17-1G>A, 1585-1G>A.
One-fits-all: CFTR-Super-Exon als Genersatz
Eine Lösung, die für alle Mutationen funktioniert (one-fits-all), erscheint aufgrund der über 2.000 verschiedenen CFTR-Mutationen attraktiver und entsprechend wird so eine generelle Lösung zur Behandlung der Mukoviszidose in den USA derzeit bevorzugt vorangetrieben: In einem großen von der Cystic Fibrosis Foundation (CFF) geförderten Konsortium arbeiten Wissenschaft und Industrie an einer Gen-Ersatz-Methode, indem ein sogenanntes „CFTR-Super-Exon“ verwendet werden soll. Das würde dann für alle Patienten passen, egal welche Mutationen vorliegen.
Aktuell sind verschiedene DNA-Therapien bei Mukoviszidose in der Entwicklung
Alle verfolgen den Ansatz, das defekte CFTR-Gen durch eine fehlerfreie Version zu ersetzen. Es werden virale Vektoren als Transportmittel genutzt und inhalative Anwendungen sind im Fokus der Entwicklungen (s.Tabelle oben).
- BI 3720931 von der Firma Boehringer Ingelheim und dem UK Genkonsortium enthält das CFTR-Gen auf einem Vektor (auf Basis eines Lentivirus) der das Potential hat, stabil in das Genom zu integrieren.
4D-710 von 4D Molecular Therapeutics ist ein auf die wesentlichen Sequenzen verkürztes CFTR-Gen in einem Adenoassoziierten Vektor, AAV. - KB407 von Krystal Biotech enthält ganze CFTR-Gen auf einem Herpes-Simplex Virus basierenden Virus (HSV-1)
- SP-101 von Spirovant ist ein verkürztes CFTR-Gen in einem Adenoassoziierten Vektor, AAV. Doxorubicin ist dem Präparat als Verstärker für die Genexpression beigefügt.
Informationen zur Gentherapie in unserem Bericht über den Europäischen CF-Kongress im Juni 2024
Eingriffe auf Ebene der RNA
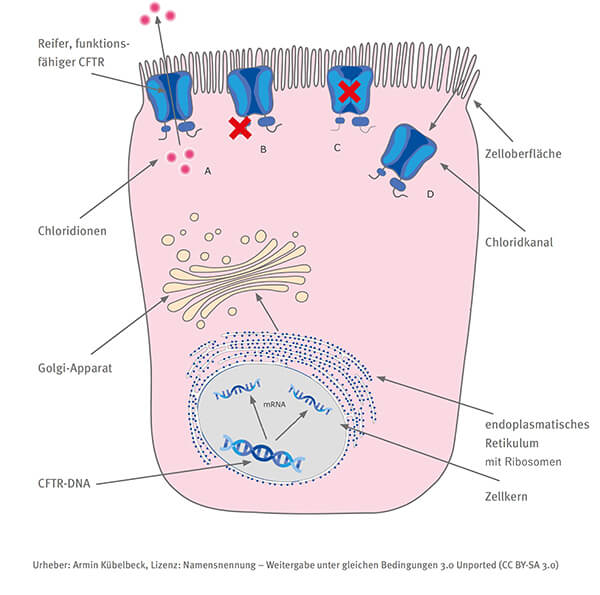
Es ist auch möglich, nicht am Original-Gen – also im Zellkern auf Ebene der DNA – anzusetzen, sondern einen Schritt später auf dem Weg vom Gen zum fertigen Genprodukt. Die mRNA ist eine Abschrift des Gens, die aus dem Zellkern heraus transportiert wird und dort als Vorlage zur Herstellung des Proteins genutzt wird. Die CFTR-mRNA trägt also die Anleitung zur Herstellung des CFTR-Kanals. Gelingt es, eine korrekte CFTR-mRNA in die Zellen zu schleusen, sollte dort der fehlende CFTR-Kanal hergestellt und in die Zellmembran eingebaut werden – egal welche Mutation auf der DNA des CFTR-Gens vorliegt.
Eine Therapie auf Ebene der mRNA ist möglich, wirkt aber nur vorübergehend
Klar ist damit aber auch, dass eine mRNA-Therapie bei Mukoviszidose keine „Heilung“ bedeutet, da die als Medikament in die Zelle eingebrachte mRNA relativ schnell wieder abgebaut wird und daher regelmäßig zugeführt werden müsste. Bei Mukoviszidose wäre hier eine Inhalationstherapie denkbar, um die Zielzellen der Lunge zu erreichen. Wie jedoch die Zellen der anderen Organe – und nur der Organe, in denen CFTR gebraucht wird, – erreicht werden können, ist noch nicht klar. Eine mRNA-Therapie zur Behandlung der Lungensymptomatik wäre aber sicherlich schon einmal ein Anfang – aber eben keine lebenslange, vollständige Heilung.
Klinische Entwicklungen von mRNA-Therapien bei Mukoviszidose
Die Firmen, Arcturus Therapeutics, Vertex/Moderna und ReCode Therapeutics haben mRNA-Entwicklungen zur Behandlung der Mukoviszidose in der klinischen Erprobung (s. auch Tabelle oben).
- VX-522 von Vertex in Kooperation mit Moderna
- ARCT-032 von Arcturus Therapeutics
- RCT2100 von ReCode Therapeutics
Informationen zu mRNA-Entwicklungen im Bericht über den Europäischen CF Kongress im Juni 2024
(Verändert nach Gestaltung von Armin Kübelbeck, Lizenz: Namensnennung – Weitergabe unter gleichen Bedingungen 3.0 Unported (CC BY-SA 3.0))
Antisense-Oligonukleotide sind kurze Nukleinsäuresequenzen die auf RNA-Ebene wirken
Es muss nicht unbedingt eine neue vollständige mRNA in die Zelle eingebracht werden, sondern die fehlerhafte mRNA kann auch vor Ort manipuliert werden, so dass der Fehler sich in der nachfolgenden Herstellung des CFTR-Proteins nicht mehr auswirkt.
Aktuell verfolgt die Firma Splisense Ansätze zur Behandlung der Mukoviszidose und ist mit SPL84 in der klinischen Forschung angelangt:
- Substanz SPL84 der Firma SpliSense ist ein Antisense-Oligonukleotid (ASO), welches zur Behandlung der Spleißmutation (3849+10 kb C->T) entwickelt wird. Die inhalative Verabreichung der ASOs ist nach ersten Untersuchungen längere Zeit wirksam, so dass die Inhalationen ggf. nur wöchentlich notwendig wären.
Aber noch weitere ASOs werden erforscht, so wurde auf Kongressen von ASO-Entwicklungen für die Behandlung der Stopp-Mutationen W1282X und G542X berichtet und Splisense arbeitet an ASOs zur Blockierung von Muzin-Genen.
Wirkstoffe, die fehlerhafte Stopp-Signale bei Nonsense-Mutationen unschädlich machen
Bei Stopp-Mutationen (Nonsense-Mutation) ist noch ein weiterer Ansatz auf mRNA-Ebene möglich. Dabei bewirken die Substanzen, dass fehlerhafte Stopp-Signale, die durch seltene CFTR-Mutationen verursacht werden, einfach bei der Herstellung des Proteins überlesen werden.
Ataluren (in CF Studien auch als PTC-124 bekannt) wurde als solch ein Read-Through-Medikament für Mukoviszidose untersucht, führte aber leider nicht zum Erfolg.
Ein ähnlicher Ansatz wurde kürzlich für Mukoviszidose mit dem Wirkstoff ELX-02 zur Behandlung der sehr seltenen Stopp-Mutationen (G542X) in einer klinischen Studie untersucht. Im September 2022 bestätigte die Firma Eloxx in einer Pressemeldung eine gute Verträglichkeit, aber leider keine signifikanten klinischen Verbesserungen. Dabei wurde die Substanz auch in Kombination mit Ivacaftor untersucht, um die Aktivität zu erhöhen.
Beide Wirkstoffe, ELX-02 und PTC-124, werden eher als Modulator verstanden, sie wirken zwar auf Ebene der mRNA (Genkopie), bestehen jedoch nicht aus Nukleinsäuren (Bausteine der DNA und RNA) und zählen daher auch per Definition des Paul-Ehrlich-Instituts (PEI) nicht zu den Gentherapeutika.
Mukoviszidose e.V. fördert Projekt zur Behandlung von Nonsense-Mutationen
In dem vom Mukoviszidose e.V. geförderten Projekt widmet sich Dr. Suki Albers aus Hamburg ebenfalls den Stopp-Mutationen. Sie arbeitet an einem etwas anderen Ansatz, durch den ebenfalls ein Durchlesen fehlerhafter Stopp-Codons erreicht werden soll, ihr Ansatz ist jedoch besonders spezifisch hinsichtlich der Bindung an die mRNA und soll dadurch vermeiden, dass ein Durchlesen auch an echten Stopp-Signalen erfolgt – was natürlich zu Schäden an anderen Proteinen in der Zelle führen könnte.
Weitere Informationen zu dem Projekt
Kombinationstherapien denkbar: Gentherapeutikum plus Modulator
Die Zukunft werden wohl eher verschiedene, vielleicht sogar patientenindividuelle Kombinationstherapien sein, die auf genetischer Ebene bewirken, dass das CFTR-Gen abgelesen und ein CFTR-Protein produziert wird und Modulatoren dafür sorgen, dass das CFTR-Protein richtig reift und/oder aktiviert wird.
Genfähren bringen das genetische Material an den Ort des Geschehens
Die oben beschriebenen Ansätze setzen entweder direkt am Erbmaterial im Zellkern, der DNA, oder aber in der Zelle auf Ebene der Gen-Kopie, der mRNA, an. Aber wie kommen die Gentherapeutika dorthin, wenn die Therapie in vivo, d. h. direkt am Menschen angewandt werden soll? Es müssen die Organe und Zellen angesteuert werden, in denen das Genprodukt eine Rolle spielt, andere Organe und Zellen hingegen sollen verschont bleiben. Das Medikament muss durch die Zellmembran – und vielleicht sogar bis in den Zellkern gelangen. Und auch die inhalative Verabreichung ist nicht einfach, schließlich ist die Lunge ein Organ, welches auf die Abwehr von Fremdstoffen – und damit auch Viren, beladen mit einem CFTR-Gen – spezialisiert ist. Und bei Mukoviszidose stellt die Schleimschicht ein zusätzliches Problem dar.
Viren als Transportmittel

Die Wissenschaft hat während der langen Zeit, in der an Gentherapien schon geforscht wird, verschiedene „Genfähren“ – auch „Vektoren“ genannt – entwickelt. Sie bedienten sich dabei zum Beispiel bei Viren, die von Natur aus bestimmte Organe und Zellen ansteuern. Die für Gentherapien entwickelten Viren gleichen jedoch immer weniger ihrem natürlichen Vorbild, sie werden genetisch soweit verändert, dass sie nur noch auf die Transportfunktion begrenzt werden und die „Ladung“ abgeben, eine Vermehrung der Viren in den Zellen hingegen wird unterbunden.
Der Nachteil ist, dass Viren, wie zum Beispiel die Adenoviren, zwar gezielt die Lungenzellen ansteuern, aber vom menschlichen Immunsystem bekämpft werden und spätestens bei wiederholten Verabreichungen nicht mehr richtig funktionieren. Adenoassoziierte Viren (AAV) sind für wiederholte Verabreichungen schon besser geeignet, haben aber eine begrenzte „Ladefläche“ und das ganze CFTR-Gen ist dafür einfach zu groß. Daher nutzen aktuelle Entwicklungen eine verkürzte CFTR-Gen Version ((Entwicklung 4D-710 und SP-101). Da AAV sich nicht in das Genom integrieren sollen, ist eine wiederholte Verabreichung für eine anhaltende Wirkung notwendig.
Vektoren auf Basis der Lentiviren sind deutlich weniger immunogen als AAV, können also wahrscheinlich wiederholt verabreicht werden, da sie keine oder nur eine schwache körpereigene Immunantwort auslösen (immunogene Vektoren würden hingegen bei der erneuten Verabreichung von der körpereigenen Immunantwort bekämpft). Außerdem haben sie eine große „Ladekapazität“, so dass das gesamte CFTR-Gen "verpackt" werden kann. Lentiviren integrieren sich stabil in das Genom, was eine Voraussetzung ist, wenn eine Gentherapie im klassischen Sinne, d. h. für immer und auf DNA-Ebene erreicht werden soll. Die Entwicklung BI 3720931 basiert auf diesem Vektor.
Relativ neu in der CF-Forschung wird HSV (Herpex Simplex Virus) als Vektor untersucht. Auch dieser Vektor kann das gesamte CFTR-Gen transportieren (Entwicklung KB407). Der Vektor soll sich nicht in das Genom integrieren, d. h. auch hier wäre dadurch wiederholte Verabreichung sinnvoll. Bei diesem Vektor weiß man noch nicht, wie gut er bei Lungenzellen funktioniert, denn er ist eigentlich auf Hautzellen spezialisiert.
Liposomale Nanopartikel und Lipid-Vesikel als Transportmittel
Molekularbiologische Methoden ermöglichen es den Forschern, sich am Baukasten der Natur zu bedienen und Vektoren zu bauen, die die Gentherapeutika (und andere Medikamente oder Impfstoffe) verpacken und an den Zielort bringen. Auch kleinste Fettkügelchen eignen sich als Transportmittel. Ein solch universell verwendbares Transportmittel hat beispielsweise Professor Joseph Rosenecker in Kooperation mit anderen Forschern entwickelt und wurde dafür 2021 durch den Mukoviszidose e.V. mit dem Adolf-Windorfer-Preis geehrt (vgl. Forschungs-News zu den liposomalen Nanopartikeln als Genfähren).
Als ganz neue Transportmittel werden nun Lipid-Vesikel und extrazelluläre Vesikel untersucht. Diese sind den natürlichen Zellen abgeschaut und können eigentlich alles transportieren, mRNA, DNA, Proteine oder andere therapeutische Substanzen/Medikamente. Es gibt verschiedene Firmen (z. B. OmniSpirant, Gensaic, RecodeTherapeutics, Carmine, Nosis Bio, Nanite), die an genetischen Therapien zur Behandlung der Mukoviszidose arbeiten, die sich allein auf die Transportmittel, die Vektoren spezialisiert haben, denn das gezielte Ansteuern der Zellen, in denen der gentherapeutische Ansatz wirken soll, ist vielleicht die noch größte Hürde derzeit. Die Wirksamkeit einer genetischen Therapie wird nicht erreicht, wenn die Zielzellen nicht erreicht werden. Die Sicherheit ist nicht gegeben, wenn falsche Zellen angesteuert werden, z. B. Zellen, die keinen CFTR-Kanal benötigen und dieser kann dort daher sogar schädlich sein.
Derzeit unterstützt der Mukoviszidose e.V. ein Forschungsprojekt von Prof. Rosenecker. Darin untersucht er die Eignung des von ihm entwickelten liposomalen Vektors präklinisch im Zell – und Tiermodell. Untersucht wird, ob der mit CFTR-mRNA beladene Vektor eine ausreichende Herstellung des CFTR-Kanals in den Zellen bewirkt.
Informationen zu dem vom Mukoviszidose e. V. geförderten Projekt
Kurzpräsentation zum Thema Vektoren in der Gentherapie (bitte auf die Bilder klicken)
Heilung der Mukoviszidose ist das Ziel – solange muss CF-Forschung weitergehen
Rückblickend erscheint der Enthusiasmus, der mit der Entdeckung des CFTR-Gens 1989 aufkam und die Gentherapie innerhalb von zehn Jahren versprach, sicherlich etwas naiv. Aber eben nur rückblickend, denn die vielen Jahre der Forschung haben die wirklichen Hürden auf dem Weg zur genetischen Therapie erst nach und nach sichtbar gemacht. Zum Glück sind aber viele dieser Hürden auch schon überwunden und die Machbarkeit der genetischen Therapie ist an anderen Erkrankungen durch zugelassene Medikamente gezeigt. Das nun verfügbare Mukoviszidose-spezifische Wissen und die neuen molekularbiologischen Werkzeuge lassen vielleicht nun das Licht am Ende des Tunnels erkennen. Auf den CF-Kongressen wird immer wieder betont, dass solange geforscht und entwickelt werden soll, bis die Abkürzung CF für „Cure found“ steht und Mukoviszidose endlich für alle heilbar wird.
Weitere Informationen zum Thema
- Februar 2023: Gentherapie bei Mukoviszidose geht weiter
- Juni 2022: ECFC 2022: Gentherapie bei Mukoviszidose
- August 2021: Gene-Editing
- Juni 2021: Mukoviszidose e.V. Update Gentherapie
- März 2021: Mukoviszidose e.V. Grundlagenforschung für eine Gentherapie
- März 21: Informationen des Mukoviszidose e.V. zu mRNA Studie MRT5005
- Muko.info Ausgabe 3/2015: Gentherapie bei Mukoviszidose
- August 2018: Antisense-Oligonukleotiden gegen ENaC mRNA
- Linksammlung Informationen zu genetischen Therapien - zusammengestellt in Zusammenarbeit mit der europäischen Patientenorganisation CFE (verschiedene Sprachen, Dokument auf Englisch)
Quellen
- Future therapies for cystic fibrosis
- UK-Gene-Therapie Consortium in Nature briefing
- Gene Therapy: A Possible Alternative to CFTR Modulators? J. Mercier et al. in Front Pharmacol. 2021 Apr 21;12:648203. doi: 10.3389/fphar.2021.648203. eCollection 2021.
- Cutting Edge Advances in Cystic Fibrosis: From Gene Therapy to Personalized Medicine; Parisi et al in Genes (Basel), 2025 Mar 30;16(4):402.doi:10.3390/genes16040402
- Publikation zu Eluforsen
- Publikation zu MRT5005
- ECFS basic science conference 2023, Abstract book
- Prime editing functionally corrects cystic fibrosis-causing CFTR mutations
- CRISPR for cystic fibrosis
- Entwicklungen in der Pipeline der Amerikanischen CF Organisation (CFF)
Die Inhalte auf dieser Seite wurden zuerst im Dezember 2021 erstellt.





