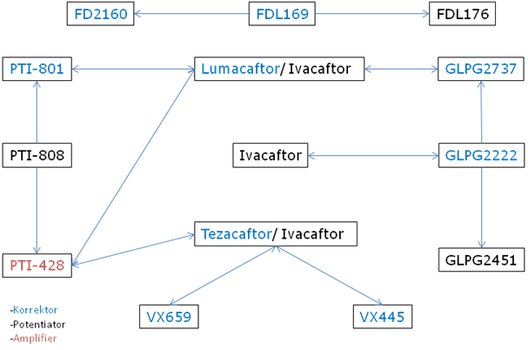
Bis zu 90% der Mukoviszidose-Betroffenen könnten in wenigen Jahren von den neuen Dreifachkombinations-Therapien profitieren. Das zumindest prognostizierte Charlotte McKee für das pharmazeutische Unternehmen Vertex in ihrem Vortrag. Bei dieser Patientengruppe handelt es sich hauptsächlich um diejenige Patienten, die mindestens eine F508del Mutation (Genveränderung) haben. Die CFTR-Modulatoren wirken immer nur bei bestimmten Mutationen, jedes dieser neuen Medikamente kommt also nur für eine bestimmte Gruppe an Patienten mit Mukoviszidose in Frage. Vertex hat bereits mehrere CFTR-Modulatoren bis zur Zulassung und damit Marktreife entwickelt: in Europa sind die Wirkstoffe Ivacaftor (Iva) und Lumacaftor/Ivacaftor (Lum/Iva) zugelassen, die Zulassung für Tezacaftor/Ivacaftor (Tez/Iva) soll im zweiten Halbjahr 2018 folgen. Weitere pharmazeutische Unternehmen entwickeln ebenfalls neue CFTR-Modulatoren. Mindestens neun Dreifachkombinationen und unzählige Einzelsubstanzen wurden auf dem ECFS-Kongress in Belgrad vorgestellt. Das sind natürlich viel zu viele, als dass alle später eine Zulassung als Medikament erhalten könnten. Nur die besten, bzw. die besten Kombinationen, werden sich am Ende durchsetzen können. In dem ECFS-Symposium stellten neben Vertex Pharmaceuticals die pharmazeutischen Unternehmen Galapagos NV, Flatley Discovery Lab und Proteostasis Therapeutics Inc. ihre Entwicklungen vor.
Ergebnisse der ersten Galapagos Dreifachkombinations-Studie für Ende 2018 erwartet
Galapagos NV setzt dabei auf eine Kombination von frühen und späten Korrektoren mit einem Potentiator so Katja Conrath in ihrem Vortrag. Die so genannte FALCON-Studie, eine open-label Studie mit der ersten Galapagos-Dreifachkombination, läuft gerade. Erste Ergebnisse werden für Ende des Jahres erwartet. Ob sich die Wirkung des Potentiators Ivacaftor bei den seltenen Gating-Mutationen (z.B. G551D) weiter verbessern lässt, untersuchte Galapagos NV in der ALBATROSS-Studie: Der Chloridwert im Schweiß konnte durch die zusätzliche Einnahme von GLPG2222 weiter deutlich reduziert werden; ein klarer Effekt auf die Lungenfunktion ergab sich in der Studie jedoch noch nicht. Der späte Korrektor GLPG2737 wird bei Patienten mit zwei F508del-Mutationen in Kombination mit Lumacaftor/Ivacaftor in der so genannten PELICAN-Studie untersucht. Erste Daten hierzu sollen in Kürze veröffentlicht werden. Galapagos gab inzwischen bekannt, dass die PELICAN-Studie keine signifikante Verbesserung der Lungenfunktion bei Kombination von GLPG2737 mit Lumacaftor/Ivacaftor zeigen konnte. Laut Conrath untersucht Galapagos NV derzeit die beiden Potentiatoren GLPG2451 und GLPG3067 sowie die frühen Korrektoren GLPG2222 und GLPG2851 und die späten Korrektoren GLPG2737 und GLPG3748.
Erste Flatley Kombinationsstudie soll 2018/2019 durchgeführt werden
Flatley Discovery Lab ist im Gegensatz zu den anderen pharmazeutischen Unternehmen nicht kommerziell. Claudia Ordonez stellte die Entwicklungen des Unternehmens vor: den Korrektor FDL169, der in der Phase 2 untersucht wird und FDL176, ein Potentiator der bisher in der Phase 1 getestet wurde. Mit der FD2160 Serie stünden weitere interessante Korrektoren zur Verfügung, die an anderer Stelle angreifen. Und weiterhin entwickelt das Unternehmen nach eigenen Angaben Substanzen, die sowohl als Korrektoren als auch Potentiatoren wirken. Besonderes Augenmerk legte die Vortragende jedoch auf einen möglichen Vorteil der FDL- Substanzen, der im Labor aufgefallen ist: Die Aktivität der Kombination aus FDL169 und FDL176 sei in Zellkultur (HBE-Zellen) zwar zunächst vergleichbar mit den Aktivitäten von Lum/Iva bzw. Tez/ Iva gewesen. Unter chronischen Bedingungen (mehr als 24 Stunden Einwirkzeit) hätte die Flatley-Kombination jedoch bereits die doppelte Aktivität von Tez/Iva erreicht. Und die Dreifachkombination aus FDL169, FDL176 und FD2160 hätte die Tez/Iva und Lum/Iva Aktivität sogar um das 3,4fache übertroffen. Ob diese Ergebnisse Rückschlüsse auf eine bessere Wirksamkeit der FDL-Substanzen bei Langzeiteinnahme erlauben, ist derzeit noch unklar. Erste klinische Daten mit FDL169 im Menschen zeigen eine gute Verträglichkeit. Offenbar trete auch nicht das typische Engegefühl in der Brust auf, das z.B. bei Lum/Iva beschrieben wurde. Eine erste Kombinationsstudie mit FDL169/FDL176 soll 2018/2019 starten.
PTI-Amplifier verbessert bei Patienten mit Lum/Iva die Lungenfunktion um zusätzliche 5%
Marija Zecevic vertrat Proteostasis Therapeutics Inc. (PTI). Die wichtigsten Modulatoren in der PTI-Pipeline sind der Korrektor PTI-801, der Potentiator PTI-808 sowie der Amplifier PTI- 428. Während Korrektoren dabei helfen, ausreichend CFTR-Kanal zu seinem Wirkort zu bringen und Potentiatoren die Aktivität der vorhandenen Kanäle verstärken, wirken Amplifier noch einen Schritt davor: sie sorgen dafür, dass mehr Ausgangsmaterial für den Zusammenbau der Kanäle vorhanden ist. Damit eignen sie sich zumindest theoretisch besonders gut für die Kombination mit anderen Modulatoren. PTI-428 kombiniert mit Lum/Iva zeigte in einer Phase-2-Studie jüngst eine mittlere Zunahme der Lungenfunktion (FEV1) um 5,2% und das zusätzlich zu den Effekten von Lum/ Iva allein, wie Frau Zecevic berichtete. In Analogie soll voraussichtlich Anfang 2019 auch eine Studie mit der Kombination des Amplifiers und Tez/Iva gestartet werden. Proteostasis stellte außerdem Daten aus einer Phase-1-Studie vor, in der Patienten, die bereits Lum/ Iva einnahmen, zusätzlich PTI 801 bekamen. Es wurden verschiedene Dosierungen getestet und es konnte eine Reduktion des Schweiß-Chloridwertes auf 55mmol/l und ein Anstieg des Körpergewichts gezeigt werden. Außerdem gab es eine Normalisierung der Glukose-Level bei hyperglykämischen CF-Patienten mit CF-Diabetes, nicht jedoch bei nicht-diabetischen Patienten oder den Patienten in der Placebo-Gruppe. Weitere Ergebnisse aus der Studie sowie Ergebnisse der ebenfalls bald startenden Dreifachkombinations-Studie mit PTI-801, PTI-808 und PTI-428 sollen noch in diesem Jahr vorgestellt werden. Die PTI Dreifachkombination soll nur noch einmal statt zweimal täglich eingenommen werden müssen.
Zwei Vertex-Dreifachkombinationsstudien sind derzeit in der Phase 3
Charlotte McKee hielt den letzten Vortrag des Symposiums und stellte die Entwicklungen von Vertex Pharmaceuticals vor. Mit VX-659 und VX-445 entwickelt Vertex zwei Korrektoren in Kombination mit Tez/ Iva. Die Daten der Phase 2 zeigten bereits Zuwächse von bis zu 13% in der Lungenfunktion (FEV1). Phase 3 Studien laufen bereits oder werden in Kürze anlaufen. Über die Studienergebnisse der Phase 2 haben wir bereits berichtet.
ELX-02, ein neuer Modulator bei Stopp-Mutationen, geht in die klinische Entwicklung
Neben den Entwicklungen in Symposium 07, gab es auch in anderen Veranstaltungen und auf Postern interessante Entwicklungen zu entdecken. So widmet sich nach dem Scheitern von Ataluren (PTC124) für Patienten mit Stoppmutationen nun das pharmazeutische Unternehmen Eloxx der Entwicklung eines neuen Modulators für diese Patientengruppe: ELX-02 soll bald in ersten klinischen Studien untersucht werden. Außerdem werden neben den klassischen CFTR-Modulatoren auch verstärkt Substanzen untersucht, die über alternative Kanäle in den Salz-Wasserhaushalt des Körpers eingreifen, z.B. der Hemmer des ENaC-Natriumkanals SPX-101. Vorteil dieser Substanzen ist die mutationsunabhängige Wirkung.
Riociguat-Entwicklung bei Mukoviszidose eingestellt
Andere Ergebnisse waren eher nicht so erfreulich: Die Entwicklung von Riociguat, Stimulator der Guanylatzyklase (sGC), ein Rezeptor für NO, wurde leider eingestellt. Das Poster P028 begründete dies mit fehlender Wirksamkeit und der sich verändernden Landschaft der CF-Therapie. Bei den 16 ausgewerteten Patienten wurde weder ein Effekt auf den Schweißchloridwert oder die nasale Potentialdifferenz festgestellt noch eine signifikante Änderung der Lungenfunktion (FEV1, LCI). Die Phase 2 Studie lief u.a. auch in deutschen Zentren.
Personalisierte Medizin für Patienten mit seltenen Mutationen: Hit-CF
Auch, wenn tatsächlich in einigen Jahren CFTR-Modulatoren für einen Großteil der Patienten mit CF zur Verfügung stehen sollten, wird es immer einen Teil an Patienten mit seltenen Mutationen geben, die durch diese Medikamente nicht erreicht werden. Klassische klinische Studien sind für diese Patientengruppe nicht durchführbar. Trotzdem ist es wahrscheinlich, dass einige der vorhandenen CFTR-Modulatoren auch bei solchen seltenen Mutationen wirken. Deshalb wird dringend nach einem guten Vorhersagemodell gesucht, in dem man untersuchen kann, welche Substanzen bei einem bestimmten Patienten wirken. Ein solches Modell könnten Organoide sein, die in dem Europäischen Großprojekt Hit-CF untersucht werden. Die Patientenorganisation CF-Europe und der Mukoviszidose e.V. unterstützen das Projekt.
Mehr zu den neuen EU-Projekten im Bereich Mukoviszidose erfahren
Zur englischsprachigen Seite des HIt CF-Projekts
Dr. Jutta Bend,
29.06.2018